Solução no final
EX-01
No estudo do equilíbrio químico
partiu-se de 1 mol de álcool etílico e 1 mol de ácido
acético. Após o equilíbrio, ter sido atingido, formaram-se x moles de acetato
de etila e x moles de água. Escreva a expressão que dá a constante de
equilíbrio da reação.
Solução no final
EX-02
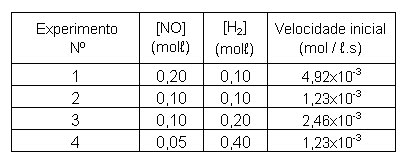
No estudo da reação
obtiveram-se os seguintes resultados:
Verifique se a relação (a – x = z) está correta quando em
equilíbrio químico.
Solução no final
EX-03 (ITA)
Identifique qual é a afirmativa FALSA.
a) aproximadamente 2,4 x 1023 moléculas de propanol deixaram
de reagir;
b) um dos produtos é um éster de massa molecular 102;
c) a massa obtida de um dos produtos é 10,8 g ;
d) 0,60 moles de ácido participaram da reação;
e) foram consumidos 0,40 moles de propanol.
Solução no final
EX-04 (POLI-USP)
A reação que se realiza em fase gasosa,
encontra-se em equilíbrio a uma dada temperatura. Fazendo-se reagir, nesta temperatura 1 mol de
CO com 1 mol de H2O, forma-se no equilíbrio uma quantidade de H2 suficiente
para hidrogenar completamente 19,6
g de etileno.
Calcular: a) a porcentagem de conversão de CO em CO2. b) a constante de equilíbrio da reação
dada.
Solução no final
EX-05 (POLI-USP)
Em um recipiente de volume constante aquece-se certa massa
de pentacloreto de fósforo à temperatura de 250ºC. Atingindo o equilíbrio nessa temperatura, o
quociente entre as pressões parciais do cloro e do pentacloreto de fósforo é
1,50. Sabendo-se que Kp=1,80 atm,
calcular a pressão total do sistema nas condições de equilíbrio químico.
Solução no final
EX-06 (POLI-USP)
A substância AB decompondo-se termicamente produz as
substâncias A e B, estando as três no estado gasoso. Sabendo-se que a pressão
total do equilíbrio é numericamente igual a três vezes o valor da constante de
equilíbrio Kp, calcular o grau de dissociação térmica da substância da
substância AB nessas condições.
Solução no final
EX-07 (PUC)
1 mol da substância A, colocado em um recipiente de 1 litro de capacidade e
aquecido a 227ºC, sofre a dissociação A(g) ↔ 2B(g). Medindo-se a constante
de equilíbrio da dissociação térmica, encontrou-se o valor Kc = 4 moles/litro.
Calcular o grau de dissociação térmica (porcentual) de A, na temperatura da
experiência.
Solução no final
EX-08 (POLI-USP)
De que maneira a pressão e a temperatura influem sobre a
quantidade de trióxido de enxofre produzido segundo a equação abaixo?
Solução no final
EX-09 (POLI-USP)
Em um recipiente de volume V, à pressão P e
temperatura T, estão contidos N2O3, NO e O2 em
proporções estequiométricas com relação à reação.
Solução no final
EX-10 (MACK)
Dar a expressão da constante de equilíbrio Kp para o
equilíbrio químico representado pela equação:
SOLUÇÕES E COMENTÁRIOS
1) Fazendo a tabela de concentrações de acordo com o enunciado:
Portanto,
2) No equilíbrio temos as seguintes relações entre os números
de moles:
z = a – x (I)
z = b – x (II)
Resposta:
Portanto, a relação (a – x = z) está correta quando em equilíbrio químico.
3) Comentário:
De forma genérica, a equação abaixo é verdadeira.
A equação de reação do enunciado fica:
Vamos fazer uma tabela para facilitar a visualização:
Verificando as alternativas:
a) Verdadeiro
Como no equilíbrio sobraram 24,0 g de propanol que corresponde a 0,4 moles;
logo, se 1 mol é igual a 6,0x1023 moléculas, então, deixaram de
reagir 0,4x6,0x1023 moléculas
de propanol.
b) Verdadeiro
A massa molecular de acetato de propila (um dos produtos) é
igual a 102 g .
c) Verdadeiro
Pela tabela acima: 10,8 g
d) Verdadeiro
Como enunciado diz que sobraram 40% de ácido acético, logo
60% participaram da reação. E sabendo
que 1 mol de ácido é igual a 60,0g. Logo
participaram 0,60 moles de ácido acético.
Foram consumidos 60% de propanol que é igual a 0,6
moles. E os 0,40 moles não participaram
da reação.
4)
Primeiro passo:
Descobrir qual é a massa necessária de H2 para hidrogenar totalmente, os
19,6 g
de etileno.
Segundo passo: Calcular a porcentagem de conversão de CO
para CO2, verificando quanto sobrou de CO quando chegou ao equilíbrio.
Observando que no equilíbrio tem-se 1,4 g de H2 foi produzido que
é 70% de 2 g
(= 1 mol). Implicando que a porcentagem de CO para CO2, também é de 70%; de
acordo com a relação estequiométrica da reação.
Foi considerado que todas as substâncias estão na mesma fase
gasosa. Portanto,
5)
Foram dados:
Calcular a pressão parcial do tricloreto de fósforo:
Calcular a pressão total do sistema:
Observando a equação da reação temos 1 mol de tricloreto de
fósforo e 1 mol de cloro no lado do produto.
Logo, se pressão parcial do tricloreto de fósforo é igual a 1,2 atm,
então, a pressão parcial do cloro, também, será 1,2 atm.
Do enunciado: O quociente entre as pressões parciais do
cloro e do pentacloreto de fósforo é 1,50.
Com esta informação podemos calcular a pressão parcial do pentacloreto
de fósforo no equilíbrio químico:
6)
Sejam n0 e p0 o número de moles
inicial e pressão parcial inicial respectivamente.
Sejam n e p, respectivamente, o número de moles e pressão
parcial na condição de equilíbrio.
E seja α o
grau de dissociação térmica. Então,
Manipulação algébrica para determinar a relação entre a pressão
parcial p e pressão inicial p0. Calcular α o grau de dissociação térmica.
7)
Seja n0 e n o número de moles inicial e número de
moles no equilíbrio respectivamente. O
grau de dissociação: α = n/n0.
E n0 é igual a 1 mol (em volume de1 litro)
Comparando as duas expressões, tem-se:
Resolvendo a equação:
Só vale a raiz positiva e este valor é aproximadamente 0,62.
Então, α =
n/n0 =0,62/1=0,62 → α = 62 %
8)
Aumentando a pressão e abaixando a temperatura, aumenta a
quantidade de trióxido de enxofre produzido.
9)
(2º) Aumentando a pressão e mantendo a temperatura
constante, o equilíbrio se desloca no sentido (2).
(3º) Aumentando a temperatura e mantendo a pressão
constante, o equilíbrio se desloca no sentido (1), pois neste sentido a reação
é endotérmica.
10)
São considerados apenas elementos no estado gasoso, pois
líquidos e sólidos não variam com a variação da pressão.
Portanto,